Громкий эксперимент по редактированию эмбрионального генома провел научный коллектив под руководством Шухрата Миталипова из Орегонского университета здоровья и науки. Ученым удалось отредактировать мутацию в гене MYBPC3, вызывающую кардиомиопатию, при помощи CRISPR–Cas9. С более-менее блестящими результатами, которые опубликовал журнал Nature.
Спустя пару месяцев успешно исправили генетическое заболевание у эмбрионов ученые из Университета Гуанчжоу. Они отредактировали мутацию, приводящую к бета-талассемии — генетическому заболеванию крови. Сегодня пациенты с бета-талассемией должны находиться под постоянным наблюдением специалистов.
Команда Шухрата Миталипова — а это американские, южнокорейские и китайские ученые — справилась с двумя ключевыми недостатками технологии CRISPR–Cas9. Им удалось избежать мозаицизма, когда часть клеток редактируется, а часть — нет. Не появилось и побочных мутаций: если бы из эмбриона вырос человек, то он ничем бы не отличался от нередактированного, с той разницей, что у него не было бы кардиомиопатии.
С помощью CRISPR можно доставлять и хранить в ДНК информацию, в том числе новые фрагменты ДНК. Внесенные в ДНК конструкции прямо на месте чинят мутации, которые приводят к генетическим заболеваниям. Технология давно уже стала обычным делом для лабораторных мышат и отдельных клеток человека — она дешевле, быстрее и проще остальных методов редактирования генома.
С практической точки зрения, шанс родить здорового ребенка, если у одного из родителей есть генетическое заболевание, увеличился с 50% до 72%. А в сочетании с экстракорпоральным оплодотворением и предварительной генетической диагностикой технология поможет родителям с кардиомиопатией однозначно зачать ребенка со здоровым сердцем.
Кардиомиопатия — заболевание, при котором сердечная мышца структурно и функционально изменена. Гипертрофическая форма встречается у одного из пятисот человек. А еще это очень удачный выбор модели болезни для исследования.
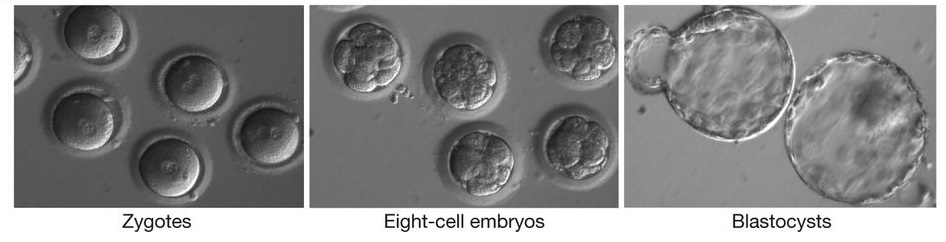
Эмбрионы, полученные в исследовании. Зиготы, восьмиклеточные эмбрионы и бластоцисты.
Сейчас мы неплохо понимаем моногенные заболевания, для развития которых достаточно мутации в одном гене у одного родителя. Кардиомиопатия — из таких, как и гемофилия, муковисцидоз, серповидно-клеточная анемия и талассемии. Но в генетике есть множество белых пятен. Существуют болезни со сложной и непонятной генетической природой, такие, как шизофрения. И не известно, какое именно наборы генов отвечают за те или иные черты внешности или характера. Поэтому никаких «дизайнерских детей» в ближайшем будущем: не только по этическим соображениям, но и по научным.
По оценкам специалиста по биомедицинской этике и юриспруденции из Стэнфордского университета Генри Грили, понадобится от 10 до 15 лет интенсивных исследований безопасности технологии, прежде чем Управление по продуктам и лекарствам США одобрит хотя бы проведение клинических испытаний. Только тогда отредактированные эмбрионы можно будет вынашивать. При этом некоторые специалисты считают, что ждать и того меньше, учитывая, что в других странах не такое строгое законодательство относительно генной инженерии.
Сейчас ученые понемногу начинают редактировать не только ДНК, но и РНК. Пока только в лабораторных условиях, но CRISPR–RCas9 уже умеет замедлять развитие бокового амиотрофического склероза (БАС) и болезни Гентингтона.
Но правительства публикуют новые законы чаще, чем ученые успевают делать открытия, поэтому в отдельных странах уже четко разделены законом:
- простые исследования;
- использование такой технологии для лечения уже имеющихся у человека заболеваний;
- редактирование генов эмбриона таким образом, что это передается будущим поколениям.
А Всемирное антидопинговое агентство заранее перестраховалось: для спортсменов с 2018 года вступает силу запрет на любые вещества, способные редактировать последовательности генов.
Даже среди этиков, теологов и представителей религии есть немало сторонников генного редактирования. А противники CRISPR–Cas9 настаивают: главная этическая проблема в том, что при редактировании генетические изменения произойдут не только в самих эмбрионах, но и в их будущих сперматозоидах и яйцеклетках. И эти изменения передадутся неопределенному количеству людей вместе со всеми неизвестными побочными эффектами.
Но пока что эта история — хорошая, в которой мы — на полпути из тьмы в борьбе с генетическими заболеваниями.
Библиография
Hong Ma, Shoukhrat Mitalipov et al. Correction of a pathogenic gene mutation in human embryos. — Nature. — 2017. — Vol. 548.
David Cyranoski. Chinese scientists fix genetic disorder in cloned human embryos. — Nature. — 2017. — Access mode: http://www.nature.com/news/chinese-scientists-fix-genetic-disorder-in-cloned-human-embryos-1.22694